morfologia
Na poziomie makroskopowym w chorobie Alzheimera można zaobserwować zmienny stopień zaniku kory (zmniejszenie masy tkanki lub narządu), charakteryzujący się powiększeniem bruzd ciemieniowych, bardziej zaakcentowany w płatach czołowych, skroniowych i ciemieniowych. Ta atrofia jest kompensowana przez powiększenie jam komorowych wtórnych do utraty miąższu (ryc. 1). W szczególności, w zaawansowanych stadiach choroby, struktury przyśrodkowego płata skroniowego, w tym hipokampa, kora śródwęchowa i ciało migdałowate, ulegają silnemu zanikowi, biorąc pod uwagę ich zaangażowanie począwszy od wczesnych stadiów patologii.
Ponadto choroba Alzheimera przedstawia również zmiany mikroskopowe, znane jako pozakomórkowe płytki starcze i wewnątrzkomórkowe skupiska neurofibrylarne, które stanowią podstawę diagnozy histologicznej. Wraz z postępem choroby występuje poważna utrata neuronów, której towarzyszy glejoza (ograniczona lub rozproszona proliferacja, reaktywna w naturze, komórki nerwowe, to znaczy komórki tworzące podścieliska zrębu tkanki nerwowej) w tych samych regionach gdzie obecność płytek neurofibrylarnych i skupisk jest większa.
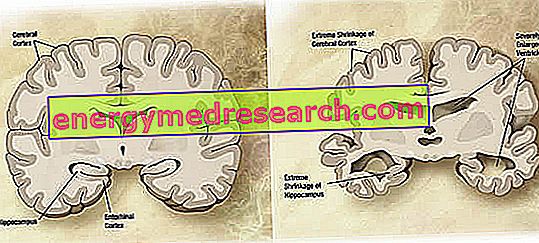
Rysunek 1. Koronalny przekrój mózgu: różnice między normalnym mózgiem a mózgiem dotknięte AD (źródło obrazu w Wikipedii).
patogeneza
Choroba Alzheimera charakteryzuje się głównie dwoma typowymi zmianami: zewnątrzkomórkową akumulacją starczych płytek składających się głównie z peptydu β-amyloidu (Aβ) i wewnątrzneuronalnych klastrów neurofibrylarnych, utworzonych przez hiperfosforylowane białko tau.
- Płytki starcze można znaleźć na poziomie obszarów mózgu, takich jak hipokamp, ciało migdałowate i kora nowa.
Peptyd Aβ pochodzi z proteolitycznego cięcia prekursora białka amyloidu (APP) przez β-sekretazę. To cięcie generuje końcowy fragment karboksylowy o 99 resztach (CTF lub C99), który jest następnie cięty przez β-sekretazę w celu wytworzenia fragmentów Aβ, mających różne długości. Wiadomo, że najbardziej rozpowszechnionym gatunkiem Aβ jest fragment Aβ40. Innym znanym fragmentem utworzonym z cięcia proteolitycznego, mniej licznym niż Aβ40, jest Aβ42, bardziej podatny na tworzenie włókienek amyloidowych, które gromadzą się jako gatunki Aβ w mózgu osobnika z chorobą Alzheimera.
- Innym składnikiem występującym w chorobie Alzheimera są gromady neurofibrylarne składające się z wiązek włókien obecnych w cytoplazmie neuronów. Klastry neurofibrylarne są nierozpuszczalne i wydają się być odporne na procesy proteolizy in vivo, dzięki czemu pozostają obecne w skrawkach tkanek nawet przez długi czas po śmierci neuronów. Obserwując strukturę, skupiska włókniste składają się z włókien podwójnej helisy i włókien liniowych o podobnym składzie. Analizując skład, nici podwójnej helisy są w większości wykonane z hiperfosforylowanego białka tau. Tau jest białkiem aksonalnym związanym z mikrotubulami, co ułatwia jego składanie.
Inne ważne zmiany neuropatologiczne występujące w chorobie Alzheimera obejmują dysfunkcję mitochondriów, oksydacyjne uszkodzenie neuronów, utratę synaptyczną i degenerację aksonów.
Aspekty neurochemiczne
Jak już wyjaśniono, peptyd Aβ, pochodzący z proteolitycznego cięcia prekursora APP, stanowi neurotoksyczny składnik choroby Alzheimera . W szczególności postawiono hipotezę, że Aβ może być ważny dla normalnych funkcji mózgu, a jeśli przezwycięży pewne stężenia, może stać się neurotoksyczny. Ponadto zarówno agregaty, jak i różne izoformy Aβ mogą mieć inną rolę biologiczną, fizjologiczną lub patologiczną, określając i uczestnicząc w kolejnych etapach choroby. Zaobserwowano, że Aβ działa jako neuromodulator, wpływając na uwalnianie niektórych neuroprzekaźników przy braku oczywistych objawów neurotoksyczności.
Na przykład neuromodulacyjna rola Aβ w kontekście fizjologicznym może mieć istotne znaczenie dla prawidłowej równowagi układu neuroprzekaźników. Powszechnie wiadomo, że system ten składa się z neuroprzekaźników, substancji przekazujących informacje między komórkami tworzącymi układ nerwowy, neuronami, poprzez transmisję synaptyczną.
Z drugiej strony, w stanach patologicznych, transmisja synaptyczna za pośrednictwem Aβ może być związana ze zmianą neurotransmisji przed zdarzeniami neurodegeneracyjnymi. W wyniku tych zmian mogą pojawić się wczesne zaburzenia poznawcze i poznawcze, oparte na dotkniętych układach neuroprzekaźników i różnych obszarach mózgu.
Zmiany w układach neuroprzekaźników i mechanizm transdukcji sygnału w mózgach osób cierpiących na chorobę Alzheimera są bardzo złożone. Jeden z systemów, który wydaje się być zmieniony, dotyczy systemu sygnalizacji cholinergicznej, który obejmuje neuroprzekaźnik acetylocholinę. W rzeczywistości wykazano, że osoby cierpiące na chorobę Alzheimera wykazują zmniejszoną transmisję cholinergiczną na poziomie kory i hipokampa, ważnych obszarów mózgu poświęconych zjawiskom takim jak uczenie się i pamięć. Oprócz tego układu neuroprzekaźnikowego w chorobie Alzheimera obserwowano zmiany w układzie noradrenergicznym, serotoninergicznym, a także glutaminianowym i GABA.