Dr Rita Fabbri
Przeciwwskazania, specjalne ostrzeżenia i odpowiednie środki ostrożności dotyczące stosowania, działania niepożądane
Żel Aloe Vera może być bezpiecznie stosowany w aplikacjach miejscowych: zakres tych produktów dostępnych na rynku jest naprawdę ogromny. Jeśli chodzi o sok z aloesu, obecnie nie ma dokładnych danych dotyczących optymalnej dawki dziennej, jednak zaleca się, aby nie przyjmować więcej niż 250 ml / dzień (38).
Do stosowania miejscowego nie są znane przeciwwskazania, nie są wymagane ostrzeżenia i nie zgłoszono żadnych działań niepożądanych. Chociaż rzadkie, zgłaszano przypadki reakcji alergicznych.
Wykazano również, że żel Aloe Vera opóźnia gojenie głębokich pionowych ran chirurgicznych, takich jak te powstałe podczas cięcia cesarskiego (39).
Do użytku systemowego, patrz załącznik poniżej.
Uwagi farmakologiczne dotyczące antrachinonów
Antrakinony są substancjami stymulującymi perystaltykę jelit, dlatego mają działanie przeczyszczające.
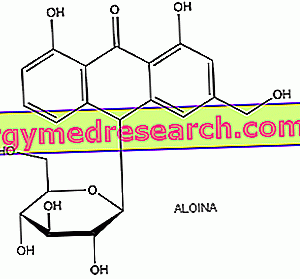
Antrakinony mają ogólną strukturę chemiczną charakteryzującą się trzema skondensowanymi pierścieniami benzenowymi i podstawnikami, które zazwyczaj zajmują pozycje 9 i 10, ponieważ są one szczególnie reaktywne. Antrakinony zwykle występują w postaci glikozydów, związków chemicznych utworzonych przez część cukrową (zwaną glikonem) i część bez cukru (zwaną aglikonem). W glikozydach antrachinonowych aglikony należą do klasy pochodnych antracenu; na przykład barbaloina jest C-glikozydem pochodzącym z antrone aloe-emodin. Postać glikozydowa pozwala na przejście tych związków w postaci niezmienionej przez żołądek i jelito cienkie aż do jelita grubego, gdzie są przekształcane przez mikroflorę bakteryjną w odpowiednie aglikony, prawdziwe aktywne metabolity, które lokalnie działają przeczyszczająco na dwa sposoby : gromadzenie się płynu w świetle jelita i modyfikacja ruchliwości jelit; po czym, bez wchłaniania, wiążą się z zawartością jelit i są wydalane z kałem.
Brak lub zmniejszenie wchłaniania glikozydów antracenu przez organizm, wraz z brakiem zmian w błonie śluzowej jelit, czyni te produkty bezpiecznymi i wolnymi od niepożądanych skutków, pod warunkiem, że przestrzegane są pewne przeciwwskazania i, co bardzo ważne, że są one stosowane w zalecanych dawkach i podawane tylko w przypadku rzeczywistej potrzeby.
Środki pobudzające pobudzające są wskazane w krótkotrwałym leczeniu sporadycznych zaparć. Z drugiej strony w przewlekłych zaparciach zmiana nawyków żywieniowych, aktywność fizyczna i reedukacja jelitowa stanowią najlepsze rozwiązanie (40–41).
Należy unikać stosowania środków przeczyszczających przez dłuższy czas i zaleca się, aby skonsultować się z lekarzem, jeśli są przyjmowane dłużej niż dwa tygodnie.
Gdy epizody zaparć występują wielokrotnie, wskazane jest zbadanie przyczyn zaburzenia.
Zaparcie nie zawsze wiąże się z atonią jelitową, czasami może być spowodowane hiperkinezją lub dyskinezą, jak w przypadku zespołu jelita drażliwego. Bardzo często zaparcia pogarszają czynniki nerwowe, lęk lub stres. We wszystkich tych przypadkach antrachinony nie są zalecane.
Wszystkie środki przeczyszczające pobudzające są przeciwwskazane w przypadku ciąży (42-44) i karmienia piersią (45) - małe ilości metabolitów przenikają do mleka matki - u dzieci poniżej 10 lat, w ostrych chorobach zapalnych jelit (wrzodziejące zapalenie jelita grubego, zapalenie jelit, zapalenie wyrostka robaczkowego, choroba Crohna), w przypadku bólu brzucha nieznanego pochodzenia, w niedrożności jelit i zwężeniu oraz w poważnych stanach odwodnienia z brakiem płynów i elektrolitów (46).
Podobnie jak wszystkie środki przeczyszczające, antrachinony nie powinny być podawane w przypadku niezdiagnozowanej, ostrej lub uporczywej symptomatologii brzusznej.
Wysokie dawki środków przeczyszczających antrachinon powodują prawie całkowite opróżnienie okrężnicy, a naturalny brak stymulacji następnego dnia (lub nawet dwa kolejne dni) może zmusić pacjentów do ponownego użycia środka przeczyszczającego, być może zwiększając dawkę; w ten sposób powstaje uzależnienie psychiczne, podyktowane lękiem podmiotu, by uregulować wszelkie opóźnienia między ewakuacją a następną.
Nadużywanie środków przeczyszczających antrachinon może powodować zaburzenia równowagi wodno-elektrolitowej, głównie hipokaliemii, okrężnicy atonicznej i nasilenia zaparć.
Hipokaliemia zwiększa działanie glikozydów nasercowych i oddziałuje z lekami przeciwarytmicznymi. Skojarzenie z innymi lekami wywołującymi hipokaliemię (takie jak tiazynowe leki moczopędne, kortykosteroidy) może nasilać zaburzenia równowagi elektrolitowej (47). Poziom elektrolitów, zwłaszcza potasu, musi być zawsze monitorowany, szczególnie u osób starszych i młodych.
Ciemna pigmentacja błony śluzowej okrężnicy, określana jako pseudomelanosis coli, obserwowana po przewlekłym przyjmowaniu środków przeczyszczających antrachinonowych (ale także innych środków przeczyszczających) nie jest szkodliwa i jest odwracalna przy zawiesinie leczenia.
Także żółto-brązowy lub czerwono-fioletowy kolor moczu (zależny od pH) z powodu działania metabolitów antrachinonu nie jest klinicznie istotny (48-49).
Czasami mogą wystąpić skurcze brzucha i ból, zwłaszcza u pacjentów z drażliwym okrężnicą. Niedawno przeprowadzono badanie obserwacyjne, które pokazuje, jak specyficzny dla jelita grubego preparat zawierający antrachinony z Senna angustifolia, zmieszany z mikrokapsułkowanymi olejkami Mentha piperita i Matricaria camomilla, jest w stanie przeciwdziałać zaparciom bez określania wyraźnych stanów zapalnych charakteryzujących się bólem, skurczami, rozdęciem stany brzuszne, meteoryt, wzdęcia i biegunka (50).
bibliografia
- Kanter, MM, wolne rodniki i ćwiczenia: efekty odżywczej suplementacji antyoksydacyjnej. Exerc. Sport Sci. Rev., 23: 375, 1995.
- Kanter, MM, i in., Wpływ antyoksydacyjnej mieszaniny witamin na peroksydację lipidów w spoczynku i po wysiłku. 74: 965, 1993.
- Yamaguchi et al. (1993) Składniki żelu Aloe Vera. Biotechnologia i biochemia nauk biologicznych. 57-8.1350-1352.
- Saben-Farideh (1993) Badania stanu enzymów przeciwutleniających i urazów oparzeń metabolicznych oraz obecność enzymów antyoksydacyjnych w roślinie Aloe Vera (czynnik martwicy nowotworów, glutation), s. 138.
- Davis, Didonato, Hartman, (1994). Działanie przeciwzapalne i gojenie ran substancji wzrostowej w Aloe vera.
- PubMed styczeń 1989. Davis, Maro.
- Lushbaugh CC i Hale DB: Eksperymentalne ostre radiodermitis po napromieniowaniu beta. V. Badanie histopatologiczne sposobu działania terapii Aloe Vera. Cancer 6, 690-698, 1953.
- Korzystne działanie aloesu w heggerach leczących rany JP, Pelley RP, Robson MC Phytotherapy Research, tom 7, S48-S52 (1993). Wydział Chirurgii i Absolwent Szkoły Nauk Biomedycznych, Uniwersytet Texas Medical Branch, Galveston, USA.
- Davis RH, Leitner MG i Russo JM: Aloe vera, naturalne podejście do leczenia ran, obrzęków i bólu w cukrzycy. J Am Pod Med Assoc 78, 60-68, 1988.
- Ajabnoor MA: Wpływ niedoborów na poziom glukozy we krwi u normalnych i alloksanowych myszy z cukrzycą. J. Etnofarmacol 28, 215-220, 1990
- El Zawahry M, Hegazy MR i Helal M: Zastosowanie aloesu w leczeniu owrzodzeń nóg i dermatoz . Int J Dermatol 12, 68-73, 1973.
- Postępowanie z łuszczycą z ekstraktem z aloesu w hydrofilowym kremie: kontrolowane placebo, podwójnie ślepe badanie Trop Med Int Health 1996 sierpień; 1 (4): 505-9 Syed TA; Ahmad SA; Holt AH; Ahmad SA, Ahmad SH; Afzal M Wydział Fizjologii Klinicznej, Szpital Uniwersytecki w Malmo, Szwecja.
- Podstawowe usługi medyczne. Instytut Ubezpieczeń Społecznych. Rep. San Marino. Styczeń 2000 Andriani, Bugli, Alders, Castelli, et al.
- Grindlay D i Reynolds T: Zjawiska liści Aloe vera: przegląd właściwości i współczesne zastosowanie żelu miąższowego. J Ethnopharmacol 16, 117-151, 1986.
- Shelton RW: Aloe vera, jego właściwości chemiczne i terapeutyczne . Int. J Dermatol 30, 679-683, 1991.
- Kahlon JB, i in.: Ocena in vitro synergistycznego działania przeciwwirusowego acemannanu w połączeniu z azydotymidyną i acyklorirem. Mol Biother 3, 214-223, 1991.
- Anonimowy: Aloe Vera może zwiększyć AZT. Med Tribune, 22 sierpnia 1991, str. 4.
- Pulse TL i Uhlig E: Znacząca poprawa w klinicznym badaniu pilotażowym z użyciem suplementów diety, niezbędnych kwasów tłuszczowych i stabilizowanego soku z aloesu u 29 pacjentów seropozytywnych, ARC i AIDS. J Adv Med 3, 209-230, 1990.
- Piosenkarka J: Randomizowane kontrolowane placebo badanie doustnego acemannanu jako uzupełnienie terapii antyretrowirusowej w zaawansowanej chorobie HIV. Int Conf AIDS 9 (1), 494, 1993. [Streszczenie nr PO-B28-2153]
- Sheets MA, et al.: Badania wpływu acemannanu na zakażenia retrowirusem: stabilizacja kliniczna kotów zakażonych wirusem białaczki kotów. Mol Biother 3, 41-45, 1991.
- Hart LA i wsp.: Wpływ składników o niskiej masie cząsteczkowej z żelu Aloe Vera na metabolizm oksydacyjny i aktywność cytotoksyczną i bakteriobójczą ludzkich neutrofili . Int J Immunol Pharmacol 12, 427-434, 1990.
- Womble D i Helderman JH: Zwiększenie trwałości ludzkich limfocytów przez acemannan (CarrisynTM). Int J Immunopharmacol 10, 967-974, 1988.
- Peng SY i wsp.: Zmniejszona śmiertelność mysiego mięsaka normańskiego u myszy leczonych immunomodulatorem, acemannan. Mol Biother 3, 79-87, 1991.
- Harris C i wsp.: Skuteczność acemannanu w leczeniu nowotworów spontanicznych u psów i kotów. Mol Biother 3, 207-213, 1991.
- Laboratoria badań nad rakiem ZSRR. 1986. Gribel, Pashinskii.
- Fujita K, Ito S, Teradaira R, Beppu H, Właściwości karboksypeptydazy z Aloe, Biochem. Pharmacol., 28: 1261-1262, 1979.
- Fujita K, Teradaira R, Nagatsu T: Aktywność bradykininazy ekstraktu aloesowego, Biochem. Pharmacol., 25: 205, 1976.
- Davis RH, et al.: Działanie przeciwzapalne Aloe vera przeciwko spektrum substancji drażniących. J Am Pod Med Assoc 79, 263-266, 1989.
- Davis RH, i in.: Izolacja aktywnego układu hamującego z ekstraktu z aloesu. J Am Pod Med Assoc 1991 May; 81 (5): 258-61.
- Saito H, Oczyszczanie substancji aktywnych Aloesu. oraz ich aktywność biologiczna i farmakologiczna, Phytother. Res., 7: S14-S1, 1993.
- Davis RH i wsp.: Aloe vera, hydrokortyzon i sterol wpływają na wytrzymałość na zranienie i działanie przeciwzapalne. J Am Pod Med Assoc, grudzień 1994; 84 (12): 614-21.
- Davis RH, i wsp.: Miejscowe działanie Aloe z kwasem rybonukleinowym i witaminą C na adiuwantowe zapalenie stawów. J Am Pod Med Assoc 75, 229-237, 1985.
- Bland J: Wpływ spożywanego doustnie soku z aloesu na funkcje przewodu pokarmowego u ludzi. Natural Foods Network Newslett, sierpień 1985.
- Blitz JJ, Smith JW i Gerard JR: Żel aloesowy w terapii wrzodów trawiennych: raport wstępny. J Am Osteopathol Soc 62, 731-735, 1963.
- Yamaguchi I, Mega N, Sanada H: Składniki żelu Aloe vera Burm-f, Biosci. Biotech. Biochem., 57 (8): 1350-1352, 1993.
- Shida T i wsp.: Wpływ wyciągu z aloesu na fagocytozę obwodową w astmie oskrzelowej dorosłych. Planta Medica 51, 273-275, 1985.
- Godding EW: Terapeutyki środków przeczyszczających ze szczególnym uwzględnieniem antrachinonów. Farmakologia 14 (Suppl 1), 78-101, 1976.
- Mocne strony i ograniczenia Aloe Vera. Rowan Hamilton American Journal of Natural Medicine, tom 5, nr 10; 30-33, grudzień 1998.
- Schmidt JM i Greenspoon JS: Żel na rany skórne z aloesu wiąże się z opóźnieniem w gojeniu się ran. Obstet Gynecol 78, 115-117, 1991.
- Steinegger E, Hansel R. Aloe. W: Pharmakognosie, 5th ed. Berlin Springer, 1992: 428-31.
- Muller-Lissner S. Niekorzystne skutki środków przeczyszczających: fakt i fikcja. Pharmacology 1993.47 (Suppl1): 138-45.
- Westendorf J. Anthranoid Derivatives - Aloe Species. W: De Smet PAGM, Keller K, Hansel R, Chandler RF, redaktorzy. Skutki uboczne leków ziołowych, tom 2. Berlin: Springer, 1993: 119-23.
- Bangel E, Pospisil M, Roetz R, Falk W. Tierexperimentelle pharmakologische Untersuchungen zur Frage der abortiven und teratogenen Wirkung sowie zur Hyperamie von Aloe. Steiner-Informationsdienst 1975; 4: 1-25.
- Schmidt L. Vergleichende Pharmakologie und Toxikologie der Laxantien. Arch Exper Path Phamakol 1995; 226: 207-18.
- Faber P, Strenge-Hesse A. Objaw wydalania reiny do mleka matki. Pharmacology 1988; 36 (Suppl 1): 212-20.
- Reynolds JEF, redaktor. Martindale - Extra Phama-copoeia. 31. ed. Londyn: Royal Pharmaceutical Society, 1996: 1202-3, 1240-1.
- Brunton LL. Środki wpływające na przepływ wody i motorykę przewodu pokarmowego, wymioty i leki przeciwwymiotne; kwasy żółciowe i enzymy trzustkowe w: Hardman JG, Limbird LE, Molinoff PB, Ruddon RW, Gilman AG, redaktorzy. Goodman i Gilman's The Pharmacological Basis of Therapeutics, 9 wyd. Nowy Jork: McGrew-Hill, 1996: 917-36.
- Niemiecki FJ. Stosowanie przeczyszczające w zaparciach. Am J Gastroenterol 1985; 80: 303-9.
- Ewe K, Karbach U. Biegunka losowa. Clin Gastroenterol 1986; 15: 723-40.
- Di Pierro F, Rapacioli G, Callegari A, Attolico M, Ivaldi L, Candidi C. Skuteczność kliniczna w zaparciu preparatu na bazie antrachinonów i olejków eterycznych: jednoczesne działanie przeczyszczające o działaniu przeciwzapalnym. Gastroenterolog ; Rok XXXI, nr 1–2 / 2009.



