Trypsyna i chymotrypsyna to dwa kluczowe enzymy w trawieniu białek pokarmowych. Oba są wytwarzane i wydzielane jako zymogeny, tj. W postaci nieaktywnej, przez trzustkę; prekursor trypsyny zymogen nazywany jest trypsynogenem, natomiast chymotrypsyna nazywany jest chymotrypsynogenem.
Trypsyna i chymotrypsyna należą do dużej rodziny enzymów proteolitycznych (zaangażowanych w trawienie białek) i podgrupy endopeptydazy. Substancje te - w tym pepsyna żołądkowa i elastaza trzustkowa - atakują wiązania peptydowe w łańcuchu aminokwasów, powodując powstawanie mniejszych fragmentów molekularnych. Enzymy należące do drugiej grupy, czyli egzopeptydazy, uzupełniają działanie trypsyny i chymotrypsyny, oddzielając poszczególne aminokwasy od końców łańcucha peptydowego; Karboksypeptydazy trzustkowe (A1, A2 i B, które atakują koniec karboksylowy) należą do tej rodziny, ale także aminopeptydazy (które atakują koniec aminowy) i dipeptydazy, zarówno wytwarzane, jak i wydzielane przez błonę śluzową jelita cienkiego. Niektóre karboksypeptydazy, podobne do obserwowanych dla trypsyny (trypsynogenu) i chymotrypsyny (chymotrypsynogenu), są wydzielane przez trzustkę w postaci nieaktywnej. We wszystkich trzech przypadkach enzymem zaangażowanym w proces aktywacji enzymatycznej jest enteropeptydaza, białko wytwarzane i wydzielane przez komórki błony śluzowej dwunastnicy; dokładniej enteropeptydaza jest swoista dla trypsynogenu, który po przekształceniu w trypsynę aktywuje również inne enzymy proteolityczne, w tym sam trypsynogen.
Różnice funkcjonalne trypsyny i chymotrypsyny dotyczą po prostu ich specyficzności, czyli zdolności do rozpoznawania i rozbijania tylko wiązań utworzonych przez dobrze zdefiniowane aminokwasy. Trypsyna oddziałuje głównie na wiązania peptydowe, które angażują podstawowe aminokwasy (takie jak arginina i lizyna), podczas gdy chymotrypsyna hydrolizuje głównie wiązania obejmujące tyrozynę, fenyloalaninę, tryptofan, leucynę i metioninę.
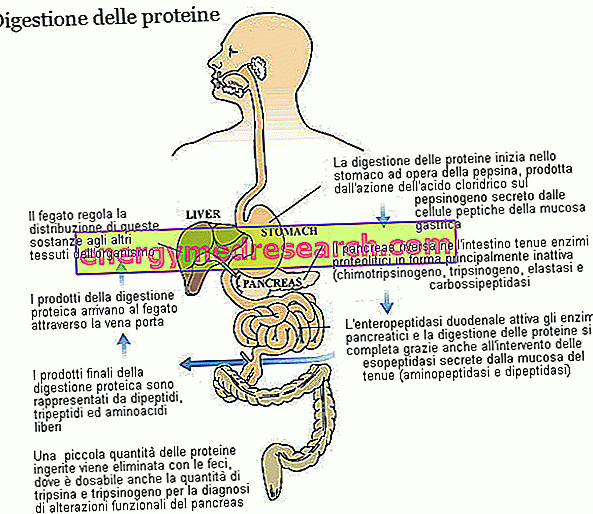
Dzięki różnym enzymom proteolitycznym, z udziałem kwasowości żołądkowej, białka dietetyczne - pierwotnie utworzone przez kilkadziesiąt aminokwasów - są rozbijane na dipeptydy, tripeptydy i wolne aminokwasy, a wszystkie łatwo przyswajalne substancje z naczyń włosowatych błony śluzowej jelit pochodzą przetransportowany do wątroby.
Trypsyna i chymotrypsyna w kale
Stosuje się oznaczanie chymotrypsyny i trypsyny w kale, a zwłaszcza w przeszłości, jako pośredni test zdolności funkcjonalnej zewnątrzwydzielniczej trzustki. Jeśli coś nie działa prawidłowo na tym poziomie gruczołu, logiczne jest oczekiwanie zmniejszonej syntezy trypsyny i chymotrypsyny, która również będzie miała niedobór kału. Test ma dobrą czułość, ale jest obciążony rzeczywistym ryzykiem fałszywie dodatnich i fałszywie ujemnych wyników. Zastosowanie środków przeczyszczających, na przykład, zmniejsza stężenie enzymów w materiale kałowym, podczas gdy spożycie wyciągów z trzustki trawiennej (takich jak pankreatyna) lub warzyw (np. Szypułka ananasowa, papaja, papaina i bromelaina) powoduje fałszywie negatywne wyniki. Również bakteryjna flora jelitowa nieznacznie wpływa na ilość trypsyny i chymotrypsyny, które docierają niezmienione w kale; z tego powodu stosowanie antybiotyków może prowadzić do fałszywie negatywnych wyników; przeciwnie, w obecności uchyłkowatości i innych stanów sprzyjających proliferacji bakterii, wyniki fałszywie dodatnie mogą być rejestrowane.
Klasycznym zastosowaniem dawki trypsyny i chymotrypsyny w kale jest wykrycie niewydolności trzustki u pacjentów z mukowiscydozą. Jedną z konsekwencji tej choroby jest zaburzenie normalnego transportu trypsyny i innych enzymów trawiennych z trzustki do dwunastnicy; z tego powodu po urodzeniu kał dziecka z mukowiscydozą jest szczególnie zwarty, powodując niedrożność jelit. W rezultacie, szczególnie małe ilości chymotrypsyny i trypsyny są rejestrowane w smółce.



