Co to jest insulina
Insulina jest hormonem o naturze białkowej, wytwarzanym przez grupy komórek trzustkowych, zwane „komórkami β wysepek Langerhansa”. Został odkryty w 1921 roku przez Anglika Johna Jamesa Macleoda i kanadyjskiego Fredericka Granta Batinga, nagrodę Nobla w dziedzinie medycyny w 1923 roku.
funkcje
Insulina jest par excellence hormonem anabolicznym, w rzeczywistości dzięki jej działaniu:
- ułatwia przejście glukozy z krwi do komórek i dlatego ma działanie hipoglikemiczne (obniża poziom cukru we krwi). Wspomaga gromadzenie glukozy w postaci glikogenu (glikogenosyntezy) w wątrobie i hamuje degradację glikogenu do glukozy (glikogenoliza).
- Ułatwia przejście aminokwasów z krwi do komórek, ma funkcję anaboliczną, ponieważ stymuluje syntezę białek i hamuje neoglukogenezę (tworzenie glukozy wychodząc z niektórych aminokwasów).
- Ułatwia przejście kwasów tłuszczowych z krwi do komórek, stymuluje syntezę kwasów tłuszczowych wychodząc z glukozy i nadmiaru aminokwasów oraz hamuje lipolizę (wykorzystanie kwasów tłuszczowych do celów energetycznych).
- Ułatwia przejście potasu do komórek.
- Stymuluje proliferację komórek.
- Stymuluje wykorzystanie glukozy do produkcji energii.
- Pobudza endogenną produkcję cholesterolu.
Największym bodźcem do działania insuliny jest posiłek bogaty w proste węglowodany i mało błonnika, tłuszczu i białka. Również niektóre leki (sulfonylomoczniki) są w stanie zwiększyć ich wydzielanie.
Insights
Insulina i sport Insulina i dopingGlikemia i odchudzanie Cukrzyca Odporność na insulinę hiperinsulinemia Szybka insulina i wolna insulina Leki na bazie insulinystreszczenie
Proinsulina jest biosyntetycznym prekursorem insuliny. Istnieje również pre-pro-insulina, która w porównaniu z proinsuliną ma sekwencję aminokwasów, która działa jako sygnał do jej transportu, najpierw w retikuloendoplazmie, a następnie w Golgim, gdzie osiąga prawidłową konformację.
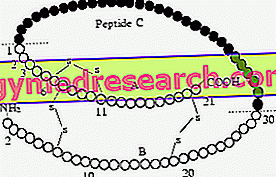
Insulina jest uwalniana jako białko globularnego łańcucha polipeptydowego unikalne dla polirybosomów; następnie hormon odkłada się w postaci granulek, osiągając postać krystaliczną widoczną pod mikroskopem elektronowym. Wraz ze wzrostem stężenia insulina jest agregowana w dimery (para monomerów utrzymywanych razem przez słabe wiązania) oraz trimery lub trimery heksamerów (utrzymywane razem przez 2 centralne jony Zaco, skoordynowane z 3 tyrozynami dimerów i trzema cząsteczkami H2O ).
Gdy insulina zostanie uwolniona do strumienia krążącego, przez rozcieńczenie przechodzi do postaci dimerycznej i monomerycznej, przy czym ta ostatnia jest rozpoznawana przez receptor insuliny.
Niektórzy badacze zauważyli, że w ludzkiej insulinie występują regiony zmienne, w szczególności sekwencja aminokwasów nr 28 i 29 (Pro-Lys) łańcucha β; następnie odkryto, że odwrócenie tej insuliny AA przechodzi bezpośrednio do stanu monometrycznego, pomijając dimeryczny. Tak narodził się „Lys Pro” lub „szybka insulina”, lek szczególnie przydatny, jeśli wstrzykuje się go w pobliżu dużego posiłku.
Mechanizm działania
Receptor insuliny jest transbłonową glikoproteiną składającą się z 4 łańcuchów (2α na zewnątrz komórki i 2β wewnątrz komórki), połączonych ze sobą mostkami siarczkowymi. Cząsteczka ma raczej krótki okres półtrwania i dlatego podlega szybkiemu obrotowi. Jest również syntetyzowany jako prekursor przez szorstką siateczkę endoplazmatyczną, a następnie przetwarzany w aparacie Golgiego. Łańcuchy 2 α są bogate w cysteiny, podczas gdy β są bogate w hydrofobowe AA, które zakotwiczają je w błonie komórkowej i tyroksyny, skierowane w stronę wewnętrznej części cytozolu.
Wiązanie receptora insuliny stymuluje aktywność kinazy tyrozynowej i prowadzi do wydatkowania 1 ATP na fosforylowaną tyrozynę. Powoduje to szereg zdarzeń łańcuchowych (aktywacja białek G fosfolipazy C), które prowadzą do powstania dwóch produktów: DAG, który pozostaje zakotwiczony w błonie i który interweniuje w fosforylacji białek oraz IP3, który działa na poziomie cytozolowym, umożliwiając Uwalnianie jonów Ca ++.
Gdy poziom cukru we krwi wzrasta, zwiększa ilość insuliny wydzielanej przez komórki trzustki. W komórkach zależnych od insuliny wiązanie receptora insuliny działa na wewnątrzkomórkową pulę pęcherzyków, uwalniając transporter glukozy, który jest przenoszony na błonę przez fuzję. Przenoszenie glukozy do komórki, powodujące obniżenie poziomu cukru we krwi, co z kolei stymuluje dysocjację insuliny i jej receptora. Ta dysocjacja wywołuje proces podobnej endocytozy, z którą nośnik jest przywracany do pęcherzyków.
Cukrzyca i insulina
Termin cukrzyca pochodzi z greckiej cukrzycy i oznacza przejście . Jednym z charakterystycznych objawów klinicznych tej patologii jest obecność cukru w moczu, który dociera do Ciebie przez nerki, gdy jego stężenie we krwi przekracza pewną wartość. Termin ten jest związany z przymiotnikiem mellitus, ponieważ mocz, ze względu na obecność cukru, jest słodki i, w starożytności, degustacja była jedynym sposobem zdiagnozowania choroby
Cukrzyca jest chorobą przewlekłą, charakteryzującą się hiperglikemią, czyli wzrostem zawartości cukrów (glukozy) we krwi. Jest to spowodowane zmniejszeniem wydzielania INSULIN lub połączeniem zmniejszonego wydzielania i oporności obwodowej na działanie tego hormonu.
W normalnych warunkach insulina uwalniana przez trzustkę dostaje się do krwioobiegu, gdzie działa jako „klucz” potrzebny do wprowadzenia glukozy do komórek, które w zależności od zapotrzebowania metabolicznego, wykorzystają ją lub złożą jako rezerwę. To wyjaśnia, dlaczego niedoborowi lub zmianie działania insuliny towarzyszy wzrost ilości krążących cukrów, co jest charakterystyczne dla cukrzycy.



