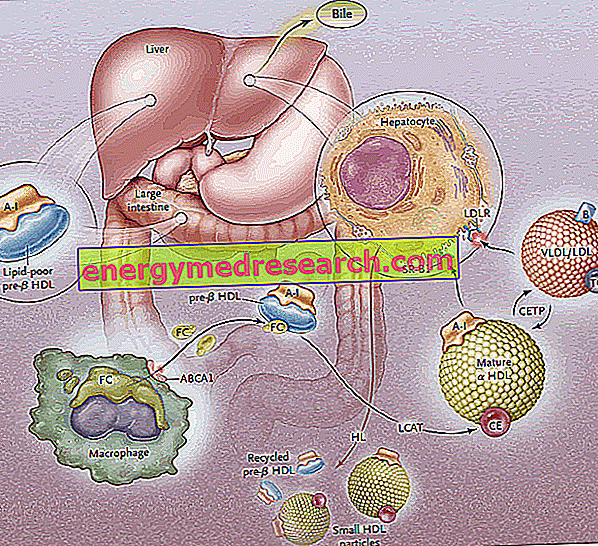
Odwrotny transport cholesterolu (RCT) jest procesem, w którym cholesterol jest usuwany z tkanek obwodowych, poprzez jego włączenie do lipoprotein HDL i następnie transport do wątroby w celu wydalenia z żółcią.
Komórki obwodowe, jak wszystkie komórki nie jelitowe lub wątrobowe, nie są zdolne do degradacji nadmiaru cholesterolu; dlatego dla utrzymania homeostazy komórkowej niezbędny jest mechanizm dedykowany do usuwania cholesterolu z komórek. Mechanizm ten, mający na celu odzyskanie nadmiaru cholesterolu obwodowego, nazywany jest „odwrotnym transportem cholesterolu” (RCT: reverse cholesterol transport ).
Przyjrzyjmy się szczegółowo procesowi.
Biosynteza lipoprotein HDL przechodzi przez syntezę i początkowe wydzielanie głównych składników białkowych (apoprotein), a następnie pozakomórkowe pozyskiwanie lipidów (fosfolipidów i cholesterolu), co prowadzi do składania i generowania dojrzałych cząstek HDL.
Pierwszy etap odwrotnego transportu cholesterolu polega na wytwarzaniu przez jelito i wątrobę dyskoidalnych prekursorów HDL, które na ich powierzchni eksponują apoproteiny (głównie ApoA-I); w ten sposób uwalniane są cząsteczki prekursorowe HDL zwane pre-B-HDL, które zawierają bardzo małe ilości cholesterolu i lipidów, zwłaszcza fosfolipidów. Obecność tych cząsteczek prekursorowych na poziomie obwodowym sprzyja przenoszeniu nadmiaru wolnego cholesterolu (FC) - uciekającego z komórek tkanki obwodowej - do apo AI, dzięki interwencji transportera błonowego zwanego kasetą wiążącą ATP A1 (ABCA1 ). Transporter ten znajduje się na powierzchni komórki i na błonach Golgiego i może transportować lipidy z aparatu Golgiego do błony komórkowej, ułatwiając ich wypływ. W tym momencie, gdy tylko wolny cholesterol dostanie się do natywnych HDL, interweniuje plazmowy enzym pochodzenia wątrobowego, zwany acylotransferazą lecytynowo-cholesterolową w osoczu lub po prostu LCAT; enzym ten przekształca wolny cholesterol włączony do pre-B-HDL w estry cholesterolu, przekształcając pre-B-HDL w ich dojrzałą postać α-HDL; w praktyce ciągła akumulacja cholesterolu w rdzeniu lipoproteinowym przekształca dyskoidalny HDL w kuliste i pulchne cząstki, które mogą dalej pozyskiwać apoproteiny z cząstek lipoprotein bogatych w trójglicerydy i zlewać się razem. W całym procesie apolipoproteina AI odgrywa kluczową rolę, stymulując zarówno aktywność transportera ABCA1, jak i LCAT. Ponieważ ApoAI jest najszerzej reprezentowaną apolipoproteiną w HDL, jej stężenie w osoczu jest bezpośrednio związane z poziomami cholesterolu HDL.
UWAGA: proces estryfikacji ma zasadnicze znaczenie dla zapobiegania redystrybucji cholesterolu z HDL do błony plazmatycznej; ten mechanizm wykorzystuje kwas tłuszczowy w pozycji drugiej obecny w cząsteczkach fosfatydylocholiny.
Proces estryfikacji za pośrednictwem LCAT przekształca następnie cząsteczki pre-B-HDL w ich „dojrzałą” sferyczną postać α-HDL. Te lipoproteiny są następnie transportowane do wątroby, gdzie uwalniają cholesterol, zgodnie z dwiema różnymi drogami.
W pierwszym przypadku HDL bogaty w estryfikowany cholesterol daje ten lipid lipoproteinom bogatym w triglicerydy (lipoproteiny o bardzo niskiej gęstości i niskiej gęstości), a następnie przechwytywany przez wątrobę przez specyficzne receptory (LDL-R) i usuwany z krążenia. Celem jest przekazanie cholesterolu obwodowego do wątroby za pośrednictwem układu receptora LDL, a następnie „uwolnienie” HDL z nadmiaru cholesterolu do poziomu obwodowego, aby ponownie je udostępnić do odbioru z tkanek; opróżniając się z cholesterolu, HDL akceptują trójglicerydy w zamian, co dzieje się dzięki białku przenoszącemu ester cholesterolu (CETP). Zadaniem tego białka jest zatem promowanie redystrybucji i równowagi estrów cholesterolu i trójglicerydów między lipoproteinami HDL, LDL, IDL, VLDL, chylomikronem i chylomikronem, prowadząc, jako wynik netto, do wzbogacenia w Trójglicerydy HDL, ze szkodą dla estrów cholesterolu, i zmniejszenie wielkości HDL.
Drugi szlak obejmuje wątrobowe receptory SR-B1 dla HDL bogatego w estryfikowany cholesterol, przy braku jednoczesnej degradacji części białkowej HDL, która jest następnie poddawana recyklingowi. W praktyce enzym ten pozwala opróżnić HDL z ich zawartości i zregenerować nowe pre-B-HDL. Część HDL i ApoA-I jest jednak internalizowana i degradowana na poziomie lizosomalnym, zarówno w komórkach wątroby, jak i nerek. Wychwyt, w którym pośredniczy SR-B1, jest bardziej wydajny dzięki aktywności lipazy wątrobowej, zdolnej do przebudowy HDL poprzez hydrolizę fosfolipidów powierzchniowych i umożliwienie przepływu zestryfikowanego cholesterolu z rdzenia lipoproteinowego w kierunku błony plazmatycznej (zakłada się, że inne, że ApoE bierze również udział w selektywnym wychwycie, ponieważ myszy pozbawione genu ApoE wykazują zmniejszenie skuteczności tego szlaku). SR-BI ulega ekspresji głównie w wątrobie, nadnerczach i jajnikach.