ogólność
Szpiczak mnogi jest nowotworem złośliwym, który atakuje niektóre komórki układu odpornościowego, powodując uszkodzenie różnych narządów i tkanek. Zwykle rozwija się u osób powyżej 50 roku życia i często towarzyszy mu ból, złamania i zniszczenie kości.
Szpiczak mnogi jest diagnozowany za pomocą testów krwi i szpiku kostnego, elektroforezy białkowej w badaniach moczu i radiologii. Remisje choroby można wywołać steroidami, chemioterapią, inhibitorami proteasomu, lekami immunomodulującymi (takimi jak talidomid lub lenalidomid) i przeszczepem komórek macierzystych.
przyczyny
Przyczyny powodujące szpiczaka mnogiego są częściowo nieznane. Ze statystyk medycznych wynika, że częstość występowania wzrasta u osób narażonych na promieniowanie jonizujące lub na określone substancje chemiczne (pochodne ropy naftowej i inne węglowodory, rozpuszczalniki, pestycydy, azbest itp.). Rodzinne czynniki genetyczne, powtarzająca się stymulacja antygenowa i czynniki wirusowe mogą również uczestniczyć w etiologii szpiczaka mnogiego.
objawy
Aby dowiedzieć się więcej: Objawy szpiczaka mnogiego
Szpiczak mnogi występuje głównie w podeszłym wieku (ponad 50 lat). Objawy mogą się znacznie różnić w zależności od osoby, ponieważ choroba może wpływać na wiele narządów. Na początku stan nie może powodować żadnych objawów. W miarę postępu choroby mogą wystąpić objawy związane z naciekiem narządów plazmatycznych i nadmiernym wytwarzaniem immunoglobulin monoklonalnych:
- Bóle kości. Ból kości dotyka prawie 70% pacjentów ze szpiczakiem mnogim i jest najczęstszym objawem. Znajduje się głównie w kręgosłupie, miednicy, żebrach, długich kościach i czaszce. Początkowa symptomatologia jest „pseudoreumatyczna”, podczas gdy ostry i uporczywy ból miejscowy może wskazywać na patologiczne złamanie kości. Zaangażowanie kręgów może prowadzić do kompresji rdzenia kręgowego. W szpiczaku mnogim uszkodzenie kości jest wtórne do pojawienia się zmian typu „litycznego” i osteopenii związanej z proliferacją komórek plazmatycznych szpiku w jamie szpikowej. Komórki szpiczaka mnogiego wytwarzają w rzeczywistości różne czynniki (zebrane w nominale OAF, czynnik aktywujący osteoklasty s), które umożliwiają osteoklastom przyspieszenie rozbiórki tkanki kostnej poprzez reabsorpcję. Ponieważ osteoblasty („producenci kości”) nie podlegają temu samemu bodźcowi proliferacyjnemu, masa kostna jest stopniowo zmniejszana. To zmienia strukturę tkanki, czyniąc kości kruche i podatne na złamania, osteoporozę i zgniecenie (kręgi). Z radiologicznego punktu widzenia przegrupowanie kości jest oczywiste ze względu na pojawienie się „perforowanych” plamek, które pokrywają się z obszarami, w których osteokondensacja jest nieobecna. Zwiększone zmiany kostne mogą również zwiększać uwalnianie wapnia we krwi (hiperkalcemia).
- Hiperkalcemia . Wysoki poziom wapnia we krwi wpływa na funkcjonowanie nerwów i powoduje nadmierne pragnienie, nudności, zaparcia, utratę apetytu i dezorientację umysłową. Hiperkalcemia jest spowodowana przenikaniem złośliwych komórek do kości.
- Niewydolność nerek. Kilka czynników wpływa na kondycję nerek. Wysokie poziomy nieprawidłowych immunoglobulin, „nieprawidłowości monclonal (białka? M), mogą powodować zmiany kanalikowe po ich odłożeniu w kłębuszkach (białkomocz Bence Jonesa). Zwiększona resorpcja kości prowadzi do hiperkalcemii i powoduje nefrokalcynozę, co przyczynia się do niewydolności nerek. Inne przyczyny obejmują nefropatię hiperurykemiczną (z odkładania się kwasu moczowego), miejscowe naciekanie komórek nowotworowych, nawracające infekcje (odmiedniczkowe zapalenie nerek) i amyloidozę.
- Niedokrwistość. W szpiczaku mnogim niedobór czerwonych krwinek wynika z braku produkcji „zdrowych” komórek krwi na korzyść klonów nowotworowych w szpiku kostnym. Niedokrwistość może prowadzić do osłabienia, ogólnego osłabienia i trudności w oddychaniu.
Te cztery problemy, wspólne dla szpiczaka mnogiego, często określa skrót CRAB, który odnosi się do poziomów wapnia, niewydolności nerek, niedokrwistości i uszkodzenia kości → C = wapń (podwyższony), R = niewydolność nerek, A = niedokrwistość, B = zmiany kostne
Inne oznaki i objawy szpiczaka mnogiego mogą obejmować:
- Zakażenia : zmniejszenie liczby białych krwinek (leukopenia) prowadzi do niedoboru odporności, a zatem do mniejszej odporności na infekcje. Mogą one mieć różną ciężkość kliniczną (zapalenie płuc, zapalenie zatok, infekcje skóry, pęcherza moczowego lub nerek) i stanowią główną przyczynę śmierci pacjentów ze szpiczakiem mnogim. Okres największego ryzyka wystąpienia zakażeń obejmuje pierwsze miesiące po rozpoczęciu chemioterapii.
- Zmiany hemostazy : brak płytek krwi (małopłytkowość) powoduje zmiany w procesie krzepnięcia, co objawia się wyraźną tendencją do krwawienia. Ogólnie okres półtrwania płytek krwi ulega zmniejszeniu, a interakcja ze śródbłonkiem naczyń ulega zmianie. Inne nieprawidłowości hemostazy wynikają ze zmniejszonej fibrynolizy.
- Zespół nadmiernej lepkości: w niektórych przypadkach szpiczaka mnogiego zwiększa się wartość lepkości plazmatycznej, która powoduje objawy krwotoczne, zaburzenia neurologiczne i niedokrwienie wieńcowe.
- Zaburzenia neurologiczne: objawy neurologiczne związane ze szpiczakiem mnogim są niejednorodne. Pojawienie się bólów neurologicznych, osłabienie lub drętwienie kończyn są najczęstszymi objawami. Wreszcie, może występować ból korzeniowy i ucisk rdzenia kręgowego z powodu zajęcia kręgów lub zespołu cieśni nadgarstka i innych neuropatii spowodowanych naciekiem złogów amyloidowych na poziomie nerwów obwodowych.
diagnoza
Lekarz może wykryć objawy szpiczaka mnogiego poprzez badania krwi i moczu przeprowadzone podczas rutynowego badania fizykalnego. Jeśli pacjent jest bezobjawowy, te testy laboratoryjne można powtarzać regularnie, aby monitorować rozwój choroby i określić najlepszy czas do rozpoczęcia leczenia. Zajęcie narządów jest ważnym kryterium diagnostycznym dla szpiczaka mnogiego.
Badania laboratoryjne
W wielu przypadkach morfologia ustala obecność niedokrwistości (Hb <10 g / dl). Rozmaz krwi obwodowej pokazuje skumulowane krwinki czerwone (krwinki czerwone), będące konsekwencją zwiększonej lepkości osocza. Często współistnieją neutropenia i małopłytkowość, które nasilają się w końcowych fazach choroby.
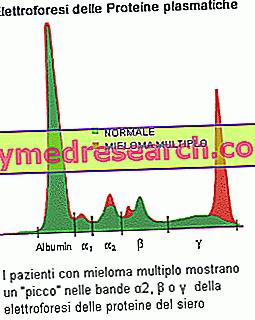
Elektroforeza białek surowicy jest w stanie wykazać obecność paraprotein wytwarzanych przez klon nowotworu: podejrzenie szpiczaka powstaje, jeśli pasmo (pik) jest istotne w profilu elektroforetycznym, ze składnikiem M> 30 g / l Innym częstym odkryciem jest białkomocz Bence Jonesa, charakteryzujący się obecnością w moczu paraprotein składających się z lekkich łańcuchów typu monoklonalnego. Ilościowe pomiary składnika M są niezbędne do ustalenia diagnozy szpiczaka mnogiego i monitorowania choroby. Badania krwi ustalają zwiększoną szybkość sedymentacji erytrocytów (ESR) i prowadzą do zmian w poziomach wapnia (podwyższone u osób z zaawansowanym szpiczakiem mnogim), albuminy (niskie poziomy skorelowane z zaawansowanym szpiczakiem), kwasu moczowego (mocznica) i kreatyniny (wzrost ze względu na zmniejszoną czynność nerek). Lekarz może również wykonać inne testy w celu sprawdzenia obecności beta-2-mikroglobuliny, innego białka produkowanego przez komórki plazmatyczne szpiczaka. Może to być przydatny wskaźnik w ocenie zaawansowania pacjenta: wysokie poziomy wskazują na bardziej zaawansowaną chorobę i gorsze rokowanie.
Techniki obrazowania
Badanie radiologiczne pokazuje zaangażowanie szkieletu. Obrazowanie rezonansu magnetycznego jest bardziej czułe niż standardowa radiografia w wykrywaniu zmian litycznych i jest w stanie wcześnie określić obecność rearanżacji kości.
Badanie szpiku kostnego
Badanie szpiku kostnego wykazuje liczne komórki plazmatyczne: wymogiem diagnostycznym dla definicji szpiczaka mnogiego jest to, że ilość klonów nowotworowych jest większa niż 10%. Część próbki jest również badana w celu oceny obecności charakterystycznych zmian kariotypu, przez konwencjonalną cytogenetykę lub zastosowanie fluorescencyjnych technik hybrydyzacji in situ (FISH). Najczęstsze anomalie chromosomowe występujące w szpiczaku mnogim obejmują chromosomy 1, 3, 5, 11, 13 i 14. W szczególności monosomia chromosomu 13 koreluje ze zmniejszonym przeżyciem, związanym z wysokim wskaźnikiem proliferacji i oporności na leki.
Inscenizacja i rokowanie
Badania diagnostyczne mogą potwierdzić obraz kliniczny szpiczaka mnogiego. Ponadto wyniki tych testów pozwalają lekarzowi sklasyfikować chorobę w stadium 1, 2 lub 3. Osoby ze szpiczakiem w stadium 3 mają jeden lub więcej objawów zaawansowanej choroby, w tym więcej klonów nowotworowych i niewydolność nerek. Ponadto wyniki biopsji szpiku kostnego pozwalają lekarzowi określić ogólny profil ryzyka pacjenta i opracować najlepszy plan leczenia.
| Stopień zaawansowania szpiczaka mnogiego (według Durie-Salmon) | ||
| Etap kliniczny | parametry | Masa guza (liczba komórek) |
| Etap 1 | Wszystkie poniższe:
| <0, 5x1012 / m2 |
| Etap 2 | Żadne z kryteriów etapu I i III | 0, 5-1, 2x1012 / m2 |
| Etap 3 | Co najmniej jeden z następujących elementów:
| > 1, 2x1012 / m2 |
Etapy 1, 2 i 3 systemu stopniowania Durie-Salmon można dalej podzielić na A lub B, w zależności od stężenia kreatyniny w surowicy:
- O: kreatyninemia <2 mg / dl (<177 mmol / l)
- B: kreatynina w surowicy> 2 mg / dl (> 177 mikromol / l)
Ostatnio zaproponowano inny system stopniowania nazywany międzynarodowym systemem stopniowania szpiczaka mnogiego .
Międzynarodowy wskaźnik prognostyczny dla szpiczaka (opublikowany przez International Staging System - 2005) | ||
stadion | kryteria | Średnie przeżycie (miesiące) |
| 62 | |
II | h42-mikroglobulina <3, 5 mg / l i albumina <3, 5 g / dl lub β2-mikroglobulina 3, 5-5, 5 mg / l niezależnie od albuminy surowicy | 44 |
III | β2-mikroglobulina ≥ 5, 5 mg / l | 29 |
leczenie
Aby dowiedzieć się więcej: Leki stosowane w leczeniu szpiczaka mnogiego
Leczenie szpiczaka mnogiego koncentruje się na terapiach zmniejszających populację klonalną. Jeśli choroba jest całkowicie bezobjawowa, postępowanie ogranicza się do obserwacji klinicznej. W obecności objawów leczenie może pomóc złagodzić ból, kontrolować powikłania, ustabilizować stan i spowolnić postęp nowotworu.
Terapia pierwszego rzutu
W ostatnich latach chemioterapia wysokodawkowa z autologicznym przeszczepem hematopoetycznych komórek macierzystych (autoprzeszczep) stała się najbardziej odpowiednią opcją terapeutyczną dla pacjentów w wieku poniżej 65 lat. Przed przeszczepem podaje się początkowy cykl chemioterapii indukcyjnej, zdolny do zmniejszenia masy nowotworowej. Najczęściej stosowane schematy obejmują podawanie talidomidu (+ deksametazon), bortezomibu i lenalidomidu (+ deksametazon). Leczenie dużymi dawkami chemioterapii i wspomaganie komórek macierzystych (autotransplantacja) nie jest lecznicze, ale może przedłużyć całkowite przeżycie i określić całkowitą remisję. Allogeniczny przeszczep komórek macierzystych, tj. Od osoby zdrowej do chorego, stanowi potencjalne lekarstwo, ale jest dostępny tylko dla niewielkiego odsetka przypadków klinicznych. Pacjenci w wieku powyżej 65 lat i ze znaczną współistniejącą chorobą często nie tolerują przeszczepu komórek macierzystych. Dla tych osób standardowe leczenie często obejmuje chemioterapię melfalanem (przez 4-7 dni) związaną z prednizonem (5-10 dni), w cyklach powtarzanych co 6 tygodni, a następnie okres odpoczynku. U niektórych pacjentów skojarzenie tego protokołu z nowymi schematami terapeutycznymi, które obejmują na przykład podawanie bortezomibu, może być przydatne. Lek ten jest inhibitorem proteasomu (kompleks wielobiałkowy obecny we wszystkich komórkach), który umożliwia pełną odpowiedź kliniczną u pacjentów z chorobą oporną lub szybko postępującą. Mechanizm działania bortezomibu opiera się na indukcji apoptozy w komórkach nowotworowych, blokując działanie proteosomów. Znacząca odpowiedź kliniczna występuje w około 50% przypadków
Terapia wspomagająca
Oprócz bezpośredniego leczenia szpiczaka mnogiego regularnie podaje się bisfosfoniany (np. Pamidronian lub kwas zoledronowy) w celu kontrolowania zmian litycznych i zapobiegania złamaniom kości. Transfuzje oparte na krwinkach czerwonych i erytropoetyna są przydatne w korygowaniu objawów związanych z niedokrwistością, podczas gdy podawanie koncentratów płytek krwi może zapobiec krwawieniu spowodowanemu małopłytkowością. Steroidy i bisfosfoniany stają się również ważne w leczeniu kryzysów hiperkalcemicznych, podczas gdy antybiotyki wspomagają leczenie infekcji.



