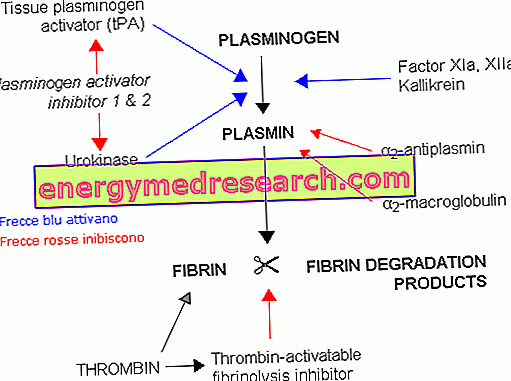
Plazmina jest głównym enzymem układu fibrynolitycznego, biologicznym procesem odpowiedzialnym za rozpuszczanie skrzepów fibrynowych powstałych po zmianach naczyniowych. Te skomplikowane polimery fibrynowe mają na celu wytworzenie pewnego rodzaju czapki krwotocznej, która zawiera komórki krwi (płytki krwi, białe krwinki i krwinki czerwone) oraz różne białka osocza. Obejmują one nieaktywny prekursor plazminy, zwany plazminogenem, który ma wysokie powinowactwo do cząsteczek fibryny. Dzięki tej charakterystyce plazminogen koncentruje się przede wszystkim w miejscach odkładania fibryny (takich jak skrzepy).
Plazminogen jest przekształcany do plazminy dzięki interwencji specyficznych naturalnych aktywatorów, w tym urokinazy (u-PA) i tkankowego aktywatora plazminogenu (t-PA). Pomimo nazwy, ta ostatnia jest bardziej aktywna na poziomie krążenia (na ogół jest wydzielana bardzo powoli, aby umożliwić procesy naprawy uszkodzeń), podczas gdy urokinaza jest bardziej aktywna na poziomie tkanek. W związku z tym, podobnie jak w przypadku koagulacji, w fibrynolizie możemy rozróżnić ścieżkę wewnętrzną i zewnętrzną, obie składające się z szeregu reakcji kaskadowych.
Układ fibrynolityczny ogranicza uszkodzenia wynikające z nadmiernego odkładania się fibryny i wynikającej z tego niedrożności naczyń z powodu nieprawidłowych skrzepów (zwanych zakrzepami).
Dzięki mechanizmowi proteolitycznemu nowo utworzona plazmina rozszczepia fibrynę na rozpuszczalne produkty degradacji. Aktywność proteazowa plazminy jest podobna do trypsyny trzustkowej i jest słabo specyficzna (oprócz plazminogenu jest także aktywna na innych substratach, takich jak składniki dopełniacza w osoczu, czynniki krzepnięcia V i VIII, fibrynogen i niektóre naturalnie występujące hormony białka, takie jak ACTH, glukagon i hormon wzrostu). Z proteolizy fibrynogenu i fibryny powstają fragmenty peptydowe o różnych rozmiarach, zwane FDP ( produkty degradacji fibrynogenu i fibryny ).
Podobnie jak w kaskadzie krzepnięcia, specyficzne inhibitory istnieją również dla kaskady proteolitycznej. W przypadku ich braku powstanie nadmierne wyburzenie fibrynogenu, fibryny i innych białek ważnych dla krzepnięcia, z niebezpieczeństwem poważnego krwawienia.
Podczas tworzenia skrzepu synteza plazminy jest generalnie hamowana przez specyficzne substancje uwalniane przez aktywowane płytki krwi i przez komórki lokalne. Tylko w obecności fibryny lub zastoju spowodowanego niedrożnością żylną, śródbłonek uwalnia nadmiar aktywatorów plazminogenu, które wiążą się ze specyficznymi receptorami powodując fibrynolizę. Podczas gdy w innych miejscach ciała receptory plazmin dla względnych inhibitorów (antyplazminy) są wolne, na poziomie skrzepu są one zaangażowane przez wiązanie z fibryną; w ten sposób plazmin jest chroniony przed ich działaniem i dlatego może w pełni wykonywać swoją działalność.
Niektóre leki, takie jak streptokinaza, zwiększają aktywność fibrynolityczną i jako takie są użyteczne w zjawiskach nadkrzepliwości krwi (zakrzepica). Z drugiej strony istnieją również leki antyfibrynolityczne, szczególnie przydatne u pacjentów z krwawieniem z powodu hiperfibrynolizy.



